Projekte Experimentelle Virologie

Prinzipien der Assemblierung und des Zelleintritts von HCV und deren Rolle in der Viruspersistenz
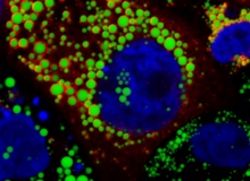
Fünfzig bis 90 Prozent aller HCV-Infektionen verlaufen chronisch. Die Verbindung von Viren mit Lipoproteinen trägt durch einen direkten Einfluss auf den Viruseintritt in die Leberzelle und außerdem durch den Schutz vor neutralisierenden Antikörpern zur Persistenz bei. Apolipoprotein E (ApoE) interagiert mit HCV-Partikeln und ApoE-Polymorphismen werden mit unterschiedlichen Verläufen der HCV-Infektion in Verbindung gebracht. Wir untersuchen Wirtsfaktoren und virale Faktoren, die die Assoziation des Virus mit Lipoproteinen beeinflussen, um ihre Rolle für die Viruspersistenz zu klären. Die Interaktion von HCV mit Lipoproteinen beginnt während der Virusassemblierung. Diese findet in den sogenannten Lipid Droplets statt, zellulären Organellen, die Lipide einlagern (Abbildung 1: Vieyres et al. PLOS Pathogens 2016).
Nach der Freisetzung von HCV-Partikeln werden zirkulierende Lipoproteine in diese Partikeln eingebaut (Bankwitz et al. J Hepatol 2017). Dieser Reifungsprozess begünstigt sowohl die Anheftung des Virus an Leberzellen als auch den Schutz von Antikörpern (Abbildung 2 und Bankwitz et al. J Hepatol 2017). Unterstützt durch den SFB900 untersuchen wir die zellulären und viralen Proteine, die die Wechselwirkung zwischen HCV und Lipoproteinen vermitteln. Letztlich sollen die so gewonnenen Erkenntnisse darüber, wie HCV mit Hilfe der Lipoproteine der Antikörperantwort entkommt, in die Entwicklung eines Impfstoffes gegen HCV einfließen.
Publikationen
Determinanten der protektiven Immunität gegen HCV: Goldstandard für die Vakzinentwicklung

Bei einer geringen Zahl aller HCV-Patienten führen starke Immunantworten zur Kontrolle und schließlich Elimination der Virusinfektion. Daher sind einige Patienten in der Lage, schützende Immunantworten gegen HCV auszubilden. Allerdings sind die genauen Eigenschaften dieses Immunschutzes nicht genau verstanden. Vor allem ist die Rolle von Antikörpern für den Schutz von HCV nicht klar definiert. Daher untersuchen wir, unterstützt durch das DZIF HCV-Vakzin-Projekt, wie Antikörper vor einer HCV-Infektion schützen. Diese Erkenntnisse wollen wir letztlich in die Entwicklung eines HCV-Impfstoffes einbringen.
Publikationen
Mechanismen des HCV-Gewebe- und Speziestropismus

HCV hat einen engen Speziestropismus und infiziert natürlicherweise nur den Menschen. Welche Faktoren dies bewirken ist noch nicht vollständig geklärt. Dass deshalb keine immunkompetenten Kleintiermodelle für HCV existieren ist ein großes Hindernis für die Impfstoffentwicklung, da eine Priorisierung von Impfstoffkandidaten im Vorfeld der kostspieligen klinischen Entwicklung dadurch verhindert wird. Die Unfähigkeit von HCV sich in nicht-menschlichen Zellen zu vermehren könnte am Fehlen oder Inkompatibilität von essentiellen Ko-Faktoren für die Virusreplikation und/oder an antiviralen Restriktionsmechanismen in nicht-menschlichen Zellen liegen, die eine Replikation des Virus effektiv verhindern. Unter diesen Annahmen wenden wir verschiedene genetische Screening-Systeme an, um ein umfassendes Profil aller relevanten Faktoren für die Speziesbarriere der HCV-Infektion in Mauszellen zu erstellen. Mithilfe dieser Informationen wollen wir in vivo-Modelle für HCV-Impfstoffforschung entwickeln. Dieses Projekt wurde durch einen ERC Starting Grant finanziert (VIRAFRONT, 2012-2017) und wird nun mit Unterstützung des Deutschen Zentrums für Infektionsforschung (DZIF) weitergeführt.
Publikationen
Antivirale Wirkstoffe gegen HCV und RSV

Wir entwickeln und nutzen Hochdurchsatz-Screeningassays, um Moleküle mit antiviraler Aktivität gegen HCV und RSV zu identifizieren. Dafür setzen wir Lumineszenz- oder Reporter-basierte Systeme und Substanzbibliotheken vom HZI, der MHH sowie von externen Kooperationspartnern ein. Diese Sammlungen bestehen aus einem großen Spektrum chemischer Grundstrukturen und komplexen Molekülen aus natürlichen Quellen (Sekundärstoffe aus Bakterien, Pilzen oder Pflanzen) sowie bereits zugelassenen Medikamenten. Unsere Expertise in virologischer Grundlagenforschung ermöglicht uns, die Wirkweisen dieser Substanzen und virale Resistenzmechanismen zu ergründen. Dabei verfolgen wir das Ziel, neue Therapieoptionen zu entwickeln
Publikationen
Wirts- und Virusfaktoren, die die Empfänglichkeit für HCV und RSV kontrollieren
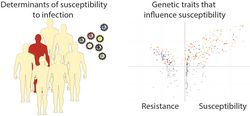
In einigen Patienten heilt die HCV-Infektion auf natürlichem Wege aus, in der Mehrzahl der Fälle wird sie jedoch chronisch. Darüber hinaus unterscheidet sich der Verlauf der chronischen Infektion zwischen Patienten. Eine Infektion mit RSV haben die meisten Kinder in den ersten 18 Monaten ihres Lebens durchgemacht. Ein Bruchteil dieser Kinder leidet unter einem schweren Verlauf der Infektion. Für beide Erkrankungen sind die Prinzipien, die der Empfänglichkeit und der Schwere der Infektion zugrunde liegen, nur unvollständig aufgeklärt. Diese Informationen sind allerdings von entscheidender Bedeutung, um eine optimale Vorsorge und medizinische Versorgung zu gewährleisten. Aus diesem Grund erforschen wir gemeinsam mit unseren klinischen Partnern an der MHH die Prinzipien der Empfänglichkeit des Wirtes für diese viralen Infektionen. Dabei nutzen wir Next Generation Sequencing-Technologien, um Eigenschaften von Wirt und Erreger zu untersuchen und zu bestimmen, welche Rolle die Wirtsgenetik für die Empfänglichkeit für die Infektion spielt. Durch Zusammenarbeit mit klinischen Forschern haben wir Zugang zu einzigartigen Patientenkohorten, die es uns gestatten, die Viruspathogenese im Menschen zu studieren. Dieses Projekt wird vom COALITION-Netzwerk und der iMed-Initiative gefördert und ist außerdem Teil des kürzlich gegründeten Centre for individualized Infection Medicine (CIIM).
Publikationen
Prinzipien der Assemblierung und des Zelleintritts von HCV und deren Rolle in der Viruspersistenz
Bankwitz D, Doepke M, Hueging K, Weller R, Bruening J, Behrendt P, Lee JY, Vondran FWR, Manns MP, Bartenschlager R, Pietschmann T (2017) Maturation of secreted HCV particles by incorporation of secreted ApoE protects from antibodies by enhancing infectivity. J Hepatol, pii: S0168-8278(17)30251-30259.
Vieyres G, Welsch K, Gerold G, Gentzsch J, Kahl S, Vondran FW, Kaderali L, Pietschmann T (2016) ABHD5/CGI-58, the Chanarin-Dorfman Syndrome Protein, Mobilises Lipid Stores for Hepatitis C Virus Production. PLoS Pathog 12(4): e1005568.
Gerold G, Meissner F, Bruening J, Welsch K, Perin PM, Baumert TF, Vondran FW, Kaderali L, Marcotrigiano J, Khan AG, Mann M, Rice CM, Pietschmann T (2015) Quantitative Proteomics Identifies Serum Response Factor Binding Protein 1 as a Host Factor for Hepatitis C Virus Entry. Cell Rep 12(5): 864-878.
Hueging K, Doepke M, Vieyres G, Bankwitz D, Frentzen A, Doerrbecker J, Gumz F, Haid S, Wolk B, Kaderali L, Pietschmann T (2014) Apolipoprotein E codetermines tissue tropism of hepatitis C virus and is crucial for viral cell-to-cell transmission by contributing to a postenvelopment step of assembly. J Virol 88(3): 1433-1446.
Gentzsch J, Brohm C, Steinmann E, Friesland M, Menzel N, Vieyres G, Perin PM, Frentzen A, Kaderali L, Pietschmann T (2013) hepatitis c Virus p7 is critical for capsid assembly and envelopment. PLoS Pathog 9(5): e1003355.
Determinanten der protektiven Immunität gegen HCV: Goldstandard für die Vakzinentwicklung
Bartenschlager R, Baumert TF, Bukh J, Houghton M, Lemon SM, Lindenbach BD, Lohmann V, Moradpour D, Pietschmann T, Rice CM, Thimme R, Wakita T. Critical challenges and emerging opportunities in hepatitis C virus research in an era of potent antiviral therapy: Considerations for scientists and funding agencies. Virus Res. 2018 Mar 15;248:53-62.
Vasiliauskaite I, Owsianka A, England P, Khan AG, Cole S, Bankwitz D, Foung SKH, Pietschmann T, Marcotrigiano J, Rey FA, Patel AH, Krey T. Conformational Flexibility in the Immunoglobulin-Like Domain of the Hepatitis C Virus Glycoprotein E2. MBio. 2017 May 16;8(3).
Bankwitz D, Doepke M, Hueging K, Weller R, Bruening J, Behrendt P, Lee JY, Vondran FWR, Manns MP, Bartenschlager R, Pietschmann T (2017) Maturation of secreted HCV particles by incorporation of secreted ApoE protects from antibodies by enhancing infectivity. J Hepatol, pii: S0168-8278(17)30251-30259.
Bankwitz D, Pietschmann T (2016) Hepatitis C virus plays hide and seek with neutralizing antibodies. Hepatology 64(6): 1840-1842.
Bankwitz D, Vieyres G, Hueging K, Bitzegeio J, Doepke M, Chhatwal P, Haid S, Catanese MT, Zeisel MB, Nicosia A, Baumert TF, Kaderali L, Pietschmann T (2014) Role of hypervariable region 1 for the interplay of hepatitis C virus with entry factors and lipoproteins. J Virol 88(21): 12644-12655.
Doerrbecker J, Friesland M, Riebesehl N, Ginkel C, Behrendt P, Brown RJ, Ciesek S, Wedemeyer H, Sarrazin C, Kaderali L, Pietschmann T, Steinmann E (2014) Incorporation of primary patient-derived glycoproteins into authentic infectious hepatitis C virus particles. Hepatology 60(2): 508-520.
Bankwitz D, Steinmann E, Bitzegeio J, Ciesek S, Friesland M, Herrmann E, Zeisel MB, Baumert TF, Keck ZY, Foung SK, Pecheur EI, Pietschmann T (2010) Hepatitis C virus hypervariable region 1 modulates receptor interactions, conceals the CD81 binding site, and protects conserved neutralizing epitopes. J Virol 84(11): 5751-5763.
Mechanismen des HCV-Gewebe- und Speziestropismus
Repressors of viral infection, WO2017/207725A1
von Schaewen M, Dorner M, Hueging K, Foquet L, Gerges S, Hrebikova G, Heller B, Bitzegeio J, Doerrbecker J, Horwitz JA, Gerold G, Suerbaum S, Rice CM, Meuleman P, Pietschmann T, Ploss A. Expanding the Host Range of Hepatitis C Virus through Viral Adaptation. MBio. 2016 Nov 8;7(6)
Anggakusuma, Brown RJ, Banda DH, Todt D, Vieyres G, Steinmann E, Pietschmann T (2016) Hepacivirus NS3/4A Proteases Interfere with MAVS Signaling in both Their Cognate Animal Hosts and Humans: Implications for Zoonotic Transmission. J Virol 90(23): 10670-10681.
Pfaender S, Grabski E, Detje CN, Riebesehl N, Lienenklaus S, Steinmann E, Kalinke U, Pietschmann T (2016) Hepatitis C Virus Stimulates Murine CD8alpha-Like Dendritic Cells to Produce Type I Interferon in a TRIF-Dependent Manner. PLoS Pathog 12(7): e1005736.
Anggakusuma, Frentzen A, Gurlevik E, Yuan Q, Steinmann E, Ott M, Staeheli P, Schmid-Burgk J, Schmidt T, Hornung V, Kuehnel F, Pietschmann T (2015) Control of hepatitis C virus replication in mouse liver-derived cells by MAVS-dependent production of type I and type III interferons. J Virol 89(7): 3833-3845.
Frentzen A, Anggakusuma, Gurlevik E, Hueging K, Knocke S, Ginkel C, Brown RJ, Heim M, Dill MT, Kroger A, Kalinke U, Kaderali L, Kuehnel F, Pietschmann T (2014) Cell entry, efficient RNA replication, and production of infectious hepatitis C virus progeny in mouse liver-derived cells. Hepatology 59(1): 78-88.
Frentzen A, Huging K, Bitzegeio J, Friesland M, Haid S, Gentzsch J, Hoffmann M, Lindemann D, Zimmer G, Zielecki F, Weber F, Steinmann E, Pietschmann T (2011) Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog 7(4): e1002029.
Antivirale Wirkstoffe gegen HCV und RSV
Labyrinthopeptins as anti-viral agents EPA16809653.5, pending
Diagnostics and therapy for human respiratory syncytial virus (hRSV) EP17195522.2, pending
Behrendt P, Perin P, Menzel N, Banda D, Pfaender S, Alves MP, Thiel V, Meuleman P, Colpitts CC, Schang LM, Vondran FWR, Anggakusuma, Manns MP, Steinmann E, Pietschmann T. Pentagalloylglucose, a highly bioavailable polyphenolic compound present in Cortex moutan, efficiently blocks hepatitis C virus entry. Antiviral Res. 2017 Nov;147:19-28.
Pietschmann T. Clinically Approved Ion Channel Inhibitors Close Gates for Hepatitis C Virus and Open Doors for Drug Repurposing in Infectious Viral Diseases. J Virol. 2017 Jan 3;91(2).
Perin PM, Haid S, Brown RJ, Doerrbecker J, Schulze K, Zeilinger C, von Schaewen M, Heller B, Vercauteren K, Luxenburger E, Baktash YM, Vondran FW, Speerstra S, Awadh A, Mukhtarov F, Schang LM, Kirschning A, Muller R, Guzman CA, Kaderali L, Randall G, Meuleman P, Ploss A, Pietschmann T (2016) Flunarizine prevents hepatitis C virus membrane fusion in a genotype-dependent manner by targeting the potential fusion peptide within E1. Hepatology 63(1): 49-62.
Haid S, Grethe C, Bankwitz D, Grunwald T, Pietschmann T (2015) Identification of a Human Respiratory Syncytial Virus Cell Entry Inhibitor by Using a Novel Lentiviral Pseudotype System. J Virol 90(6): 3065-3073.
Koutsoudakis G, Romero-Brey I, Berger C, Perez-Vilaro G, Monteiro Perin P, Vondran FW, Kalesse M, Harmrolfs K, Muller R, Martinez JP, Pietschmann T, Bartenschlager R, Bronstrup M, Meyerhans A, Diez J (2015) Soraphen A: A broad-spectrum antiviral natural product with potent anti-hepatitis C virus activity. J Hepatol 63(4): 813-821.
Anggakusuma, Colpitts CC, Schang LM, Rachmawati H, Frentzen A, Pfaender S, Behrendt P, Brown RJ, Bankwitz D, Steinmann J, Ott M, Meuleman P, Rice CM, Ploss A, Pietschmann T, Steinmann E (2014) Turmeric curcumin inhibits entry of all hepatitis C virus genotypes into human liver cells. Gut 63(7): 1137-1149.
Haid S, Novodomska A, Gentzsch J, Grethe C, Geuenich S, Bankwitz D, Chhatwal P, Jannack B, Hennebelle T, Bailleul F, Keppler OT, Poenisch M, Bartenschlager R, Hernandez C, Lemasson M, Rosenberg AR, Wong-Staal F, Davioud-Charvet E, Pietschmann T (2012) A plant-derived flavonoid inhibits entry of all HCV genotypes into human hepatocytes. Gastroenterology 143(1): 213-222 e215.
Wirts- und Virusfaktoren, die die Empfänglichkeit für HCV und RSV kontrollieren
Diagnostics and therapy for human respiratory syncytial virus (hRSV) EP17195522.2, pending
Baier C, Haid S, Beilken A, Behnert A, Wetzke M, Brown RJP, Schmitt C, Ebadi E, Hansen G, Schulz TF, Pietschmann T, Bange FC. Molecular characteristics and successful management of a respiratory syncytial virus outbreak among pediatric patients with hemato-oncological disease. Antimicrob Resist Infect Control. 2018 Feb 13;7:21.
Weller R, Hueging K, Brown RJP, Todt D, Joecks S, Vondran FWR, Pietschmann T (2017) Hepatitis C virus strain-dependent usage of apolipoprotein E modulates assembly efficiency and specific infectivity of secreted virions. J Virol. pii: JVI.00422-17.
Vieyres G, Welsch K, Gerold G, Gentzsch J, Kahl S, Vondran FW, Kaderali L, Pietschmann T (2016) ABHD5/CGI-58, the Chanarin-Dorfman Syndrome Protein, Mobilises Lipid Stores for Hepatitis C Virus Production. PLoS Pathog 12(4): e1005568.
Hedenstierna M, Weiland O, Brass A, Bankwitz D, Behrendt P, Uhnoo I, Aleman S, Cardell K, Fryden A, Norkrans G, Eilard A, Glaumann H, Pietschmann T, Sallberg M, Brenndorfer ED (2015) Long-term follow-up of successful hepatitis C virus therapy: waning immune responses and disappearance of liver disease are consistent with cure. Aliment Pharmacol Ther 41(6): 532-543.
Doerrbecker J, Friesland M, Riebesehl N, Ginkel C, Behrendt P, Brown RJ, Ciesek S, Wedemeyer H, Sarrazin C, Kaderali L, Pietschmann T, Steinmann E (2014) Incorporation of primary patient-derived glycoproteins into authentic infectious hepatitis C virus particles. Hepatology 60(2): 508-520.
Haid S, Grethe C, Dill MT, Heim M, Kaderali L, Pietschmann T (2014) Isolate-dependent use of claudins for cell entry by hepatitis C virus. Hepatology 59(1): 24-34.
