Projekte Experimentelle Virologie

Prinzipien der Assemblierung und des Zelleintritts von HCV und deren Rolle in der Viruspersistenz
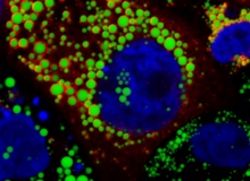
Zelluläre Lipid Droplets sind wichtig für den Beginn der HCV-Assemblierung und tragen dadurch zur Interaktion von HCV mit Lipoproteinen bei. Lipid Droplets sind mit einem Lipidfarbstoff grün gefärbt, HCV-Proteine, die sich auf den Lipid Droplets anlagern, sind rot gefärbt. Zellkerne in blau gegengefärbt. (Dr. Gabrielle Vieyres).
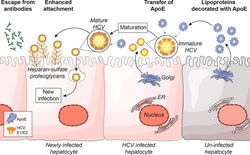
Modell der Reifung von HCV-Partikeln nach der Freisetzung von Virionen durch infizierte Zellen. Diese Abbildung wurde veröffentlicht in Journal of Hepatology, Volume 67, Bankwitz et al., Maturation of secreted HCV particles by incorporation of secreted ApoE protects from antibodies by enhancing infectivity, 480-489, Copyright Elsevier (2017).
Fünfzig bis 90 Prozent aller HCV-Infektionen verlaufen chronisch. Die Assoziation des Virus mit Lipoproteinen trägt zu seiner Persistenz bei, indem sie den Eintritt des Virus in die Leberzelle direkt beeinflusst und es vor neutralisierenden Antikörpern schützt.
Wir untersuchen Wirtsfaktoren und virale Faktoren, die die Assoziation des Virus mit Lipoproteinen beeinflussen, um ihre Rolle bei der viralen Persistenz zu klären. Die Interaktion von HCV mit Lipoproteinen beginnt während der Virusassemblierung. Dies geschieht in den sogenannten "Lipidtropfen", zellulären Organellen, die Lipide speichern (Abbildung 1 : Vieyres et al. PLoS Pathogens 2016 ). HCV nutzt zelluläre Lipasen wie ATGL, um Lipide für die Bildung von HCV Lipoviropartikeln zu mobilisieren (Vieyres et al. PLoS Pathogens 2020).
Nach der Freisetzung von HCV-Partikeln werden zirkulierende Lipoproteine in diese Partikel eingebaut (Bankwitz et al. J Hepatol 2017). Dieser Reifungsprozess fördert die Bindung des Virus an Leberzellen und den Antikörperschutz (Abbildung 2 und Bankwitz et al. J Hepatol 2017). Mit Unterstützung des SFB900 untersuchen wir die zellulären und viralen Proteine, die die Interaktion zwischen HCV und Lipoproteinen vermitteln. Die gewonnenen Erkenntnisse darüber, wie HCV mit Hilfe von Lipoproteinen der Antikörperreaktion entgeht, werden letztlich die Entwicklung eines Impfstoffs gegen HCV leiten.
Determinanten der protektiven Immunität gegen HCV: Goldstandard für die Vakzinentwicklung
Bei einer geringen Zahl aller HCV-Patienten führen starke Immunantworten zur Kontrolle und schließlich Elimination der Virusinfektion. Allerdings sind die Eigenschaften dieses natürlichen Immunschutzes nicht genau verstanden. Vor allem ist die Rolle von Antikörpern für den Schutz von HCV nicht klar definiert. Daher untersuchen wir, unterstützt durch das DZIF HCV-Vakzin-Projekt, wie Antikörper vor einer HCV-Infektion schützen. Welche Eigenschaften haben die Antikörper, die bei einer ausheilenden HCV-Infektion entstehen? Wie unterscheiden sich diese Antikörpern von denen, die gebildet werden, wenn die Infektion chronisch wird? Werden unterschiedliche Bereiche der viralen Hüllproteine attakiert? Welche Faktoren beeinflussen die Bildung besonders guter Antikörper und wie gut sind die Antikörper, die Vakzinekandidaten induziern? Diesen Fragen gehen wir nach, um einen Impfstoff zu entwickeln, der besonders gut schützende Antikörper induziert.
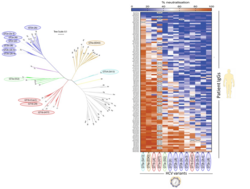
Um einen präzisen Maßstab für schützende Immunität zu entwickeln, haben wir zunächst Antikörper aus dem Blut von 104 HCV-positiven Patienten isoliert und anschließend hinsichtlich ihrer neutralisierenden Eigenschaften gegen möglichst vielen verschiedenen HCV-Varianten untersucht. Mit Hilfe von bioinformatischen Methoden haben wir gelernt, dass Varianten unabhängig von ihrem genetischen Hintergrund unterschiedlich auf Antikörper reagieren. Unsere Ergebnisse können dazu beitragen in Zukunft einen breit wirksamen Impfstoff zu entwickeln sowie die Wirksamkeit von Impfstoffkandidaten einzuschätzen.
Tour to HCV neutralization space. Final stop: B-cell vaccine | Nature Portfolio Webcasts
Mechanismen des HCV-Gewebe- und Speziestropismus
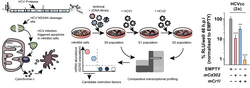
Unter Verwendung einer cDNA-Bibliothek für Gene, die in der Mausleber exprimiert werden, wurden n4mBid-Zellen transduziert und mit HCV infiziert. n4mBid-Zellen enthalten ein modifiziertes Bid-Protein, das gespalten wird, wenn die Zelle produktiv mit HCV infiziert ist, wodurch infizierte Zellen zum Absterben gezwungen werden. Zellen, die schützende Gene enthielten, überlebten und wurden so selektiert. Eine anschließende vergleichende Genexpressionsanalyse identifizierte diese Schutzgene. Auf diese Weise wurden das Lektin CD302 und der Komplementrezeptor CR1L als Restriktionsfaktoren identifiziert, die einzeln und gemeinsam die HCV-Infektion in Leberzellen verhindern.
Angepasst von Brown et al. 2020.
Aufgrund seines engen Speziestropismus kommt die natürliche Infektion mit HCV nur beim Menschen vor. Die Faktoren, die diesen begrenzten Tropismus bestimmen, sind noch nicht vollständig geklärt. Infolgedessen ist es schwierig, die HCV-Infektion in Tiermodellen zu untersuchen. Dies erschwert die Entwicklung eines HCV-Impfstoffs, da es unmöglich ist, direkt zu beurteilen, ob ein Impfstoffkandidat vor einer HCV-Infektion schützen kann, wenn kein immunologisch kompetentes Kleintiermodell vorhanden ist. Die Unfähigkeit von HCV, sich in nicht-menschlichen Zellen zu vermehren, könnte auf das Fehlen oder die Unverträglichkeit wesentlicher Kofaktoren für die virale Replikation und/oder auf antivirale Restriktionsmechanismen in nicht-menschlichen Zellen zurückzuführen sein, die die virale Replikation wirksam verhindern. Unter diesen Annahmen wenden wir verschiedene genetische Screening-Systeme an, um ein umfassendes Profil aller relevanten Faktoren für die Speziesbarriere gegen HCV-Infektionen in Mäusezellen zu erstellen. Mit diesen Informationen wollen wir In-vivo-Modelle für die HCV-Impfstoffforschung entwickeln. Dieses Projekt wurde durch einen ERC Starting Grant (VIRAFRONT, 2012-2017) gefördert und wird nun mit Unterstützung des Deutschen Zentrums für Infektionsforschung (DZIF) und eines Zuschusses der National Institutes of Health (NIH, USA) weitergeführt. Durch ein genomweites cDNA-Screening haben wir zwei neue murine Restriktionsfaktoren identifiziert, die eine HCV-Infektion von murinen Leberzellen unterdrücken. Das Lektin CD302 und der Komplementrezeptor CR1L wirken zusammen, indem sie das Eindringen des HCV in die Zelle behindern und transkriptionelle Veränderungen auslösen, die die HCV-Infektion blockieren (Brown et al. 2020). Die Ausschaltung von CD302 erhöht die Anfälligkeit für HCV-Infektionen bei transgenen Tieren, die den HCV-Rezeptor exprimieren. Diese Ergebnisse zeigen eine neue Facette der lebereigenen Immunität auf und weisen auf neue Wege für die Entwicklung von Tiermodellen zur weiteren Qualifizierung von HCV-Impfstoffen hin. Interessanterweise wird das humane CD302 auch in menschlichen Leberzellen exprimiert und schränkt die HCV und HEV-Infektion teilweise ein (Reinecke et al. J. Virol. 2022).
Antivirale Wirkstoffe gegen HCV, RSV und Coronavirus
Wir entwickeln und nutzen Hochdurchsatz-Screening-Assays, um Moleküle mit antiviraler Aktivität gegen RSV und SARS-CoV-2 zu identifizieren. Dazu verwenden wir lumineszenz- oder reporterbasierte Systeme und greifen auf Substanzbibliotheken des HZI, der MHH und anderer externer Kooperationspartner zurück. So arbeiten wir beispielsweise mit dem Scripps Institute zusammen und nutzen die ReFRAME-Substanzbibliothek zum Repurposing. Die ReFRAME-Bibliothek ist die weltweit größte Sammlung von bereits zugelassenen oder klinisch erprobten Wirkstoffen. Die von uns verwendeten Sammlungen umfassen ein breites Spektrum an chemischen Grundstrukturen, komplexe Moleküle aus natürlichen Quellen (Sekundärmetaboliten aus Bakterien, Pilzen oder Pflanzen) sowie bereits zugelassene Arzneimittel. Unsere Expertise in der virologischen Grundlagenforschung ermöglicht es uns, die Wirkungsweise dieser Substanzen und virale Resistenzmechanismen aufzuklären. Dabei verfolgen wir das Ziel, neue Therapiemöglichkeiten zu entwickeln.
In Zusammenarbeit mit Experten am HZI haben wir die Wirkungsweise von Labyrinthopeptinen gegen verschiedene Viren analysiert. Labyrinthopeptine binden bestimmte Lipide und führen zur Zerstörung der Membranen von Viren. Dies macht sie zu einem sehr breiten antiviralen Molekül, gegen das Viren nur schwer eine Resistenz entwickeln können. (Blockus et al. 2020).
Gefördert durch das Helmholtz International Laboratory for Anti-Infectives und als Teil eines internationalen Konsortiums haben wir einen neuen Wirkmechanismus zur Behandlung von RSV-Infektionen aufgedeckt. RSV konzentriert seine Bestandteile für die RNA-Vermehrung in sogenannten "inclusion bodies". Diese flüssigen Organellen spielen eine entscheidende Rolle bei der Genomreplikation und der viralen Transkription. Der neue Wirkstoff härtet diese viralen Replikationsorganellen und unterbricht auf diese Weise die Infektion des Virus (Risso-Ballester et al. Nature 2021).
Publikationen
Wirts- und Virusfaktoren, die die Empfänglichkeit für HCV und RSV kontrollieren
Bei einigen Patienten heilt eine HCV-Infektion von selbst aus, in den meisten Fällen wird sie jedoch chronisch. Außerdem ist der Verlauf der chronischen Infektion von Patient zu Patient unterschiedlich. Die meisten Kinder werden in den ersten 18 Lebensmonaten mit RSV infiziert. Ein Teil dieser Kinder erleidet einen schweren Verlauf der Infektion. Bei beiden Erkrankungen sind die Prinzipien der zugrunde liegenden Anfälligkeit und des Schweregrads der Infektion noch nicht vollständig geklärt. Diese Informationen sind jedoch entscheidend, um eine optimale Prävention und medizinische Versorgung zu gewährleisten. Aus diesem Grund arbeiten wir mit unseren klinischen Partnern an der MHH zusammen, um die Grundlagen der Anfälligkeit des Wirts für diese Virusinfektionen zu erforschen. Mit Hilfe von Sequenzierungstechnologien der nächsten Generation werden Wirts- und Erregermerkmale untersucht, um festzustellen, welche Rolle die Wirtsgenetik bei der Anfälligkeit für Infektionen spielt. Durch die Zusammenarbeit mit klinischen Forschern haben wir Zugang zu einzigartigen Patientenkohorten, die es uns ermöglichen, die virale Pathogenese beim Menschen zu untersuchen. Dieses Projekt wird durch den Exzellenzcluster RESIST und das INDIRA-Netz finanziert.
Publikationen
Prinzipien des Aufbaus und des Zelleintritts des Hepatitis-C-Virus (HCV) und ihre Bedeutung für die Resistenz gegen Antikörper
Vieyres G, Reichert I, Carpentier A, Vondran FWR, Pietschmann T. The ATGL lipase cooperates with ABHD5 to mobilize lipids for hepatitis C virus assembly. PLoS Pathog. 2020 Jun 15;16(6):e1008554. doi: 10.1371/journal.ppat.1008554. PMID: 32542055; PMCID: PMC7316345.
Bankwitz D, Doepke M, Hueging K, Weller R, Bruening J, Behrendt P, Lee JY, Vondran FWR, Manns MP, Bartenschlager R, Pietschmann T. Maturation of secreted HCV particles by incorporation of secreted ApoE protects from antibodies by enhancing infectivity. J Hepatol. 2017 Apr 22. pii: S0168-8278(17)30251-9.
Vieyres G, Welsch K, Gerold G, Gentzsch J, Kahl S, Vondran FW, Kaderali L, Pietschmann T. ABHD5/CGI-58, the Chanarin-Dorfman Syndrome Protein, Mobilises Lipid Stores for Hepatitis C Virus Production. PLoS Pathog. 2016 Apr 28;12(4):e1005568.
Gerold G, Meissner F, Bruening J, Welsch K, Perin PM, Baumert TF, Vondran FW, Kaderali L, Marcotrigiano J, Khan AG, Mann M, Rice CM, Pietschmann T. Quantitative Proteomics Identifies Serum Response Factor Binding Protein 1 as a Host Factor for Hepatitis C Virus Entry. Cell Rep. 2015 Aug 4;12(5):864-78.
Hueging K, Doepke M, Vieyres G, Bankwitz D, Frentzen A, Doerrbecker J, Gumz F, Haid S, Wölk B, Kaderali L, Pietschmann T. Apolipoprotein E codetermines tissue tropism of hepatitis C virus and is crucial for viral cell-to-cell transmission by contributing to a postenvelopment step of assembly. J Virol. 2014 Feb;88(3):1433-46.
Gentzsch J, Brohm C, Steinmann E, Friesland M, Menzel N, Vieyres G, Perin PM, Frentzen A, Kaderali L, Pietschmann T. hepatitis c Virus p7 is critical for capsid assembly and envelopment. PLoS Pathog. 2013;9(5):e1003355.
Finanzierung:
SFB900: Microbial Persistence and its Control
RESIST: Resolving Infection Susceptibility
Determinanten der protektiven Immunität gegen HCV: Goldstandard für die Vakzinentwicklung
Weber, T., Potthoff, J., Bizu, S., Labuhn, M., Dold, L., Schoofs, T., Horning, M., Ercanoglu, M. S., Kreer, C., Gieselmann, L., Vanshylla, K., Langhans, B., Janicki, H., Ströh, L. J., Knops, E., Nierhoff, D., Spengler, U., Kaiser, R., Bjorkman, P. J., Krey, T., … Klein, F. (2022). Analysis of antibodies from HCV elite neutralizers identifies genetic determinants of broad neutralization. Immunity, 55(2), 341–354.e7
Bankwitz, D., Bahai, A., Labuhn, M., Doepke, M., Ginkel, C., Khera, T., Todt, D., Ströh, L. J., Dold, L., Klein, F., Klawonn, F., Krey, T., Behrendt, P., Cornberg, M., McHardy, A. C., & Pietschmann, T. (2020). Hepatitis C reference viruses highlight potent antibody responses and diverse viral functional interactions with neutralising antibodies. Gut, gutjnl-2020-321190. Advance online publication. https://doi.org/10.1136/gutjnl-2020-321190
Bartenschlager R, Baumert TF, Bukh J, Houghton M, Lemon SM, Lindenbach BD, Lohmann V, Moradpour D, Pietschmann T, Rice CM, Thimme R, Wakita T (2018) Critical challenges and emerging opportunities in hepatitis C virus research in an era of potent antiviral therapy: considerations for scientists and funding agencies. Virus Res. 248: 53-62.
Vasiliauskaite I, Owsianka A, England P, Khan AG, Cole S, Bankwitz D, Foung SKH, Pietschmann T, Marcotrigiano J, Rey FA, Patel AH, Krey T (2017) Conformational Flexibility in the Immunoglobulin-Like Domain of the Hepatitis C Virus Glycoprotein E2. MBio 8(3).
Bankwitz D, Doepke M, Hueging K, Weller R, Bruening J, Behrendt P, Lee JY, Vondran FWR, Manns MP, Bartenschlager R, Pietschmann T (2017) Maturation of secreted HCV particles by incorporation of secreted apoE protects from antibodies by enhancing infectivity. J Hepatol 67(3): 480-489.
Bankwitz D, Pietschmann T (2016) Hepatitis C virus plays hide and seek with neutralizing antibodies. Hepatology 64(6): 1840-1842.
Finanzierung:
DFG: Development of germline-targeting HCV E2 immunogens to drive neutralizing antibody evolution
DZIF: Hepatitis C Control: Toward prophylaxis and identificatin of those in need of treatment TTU 05.821_00
HZI: MCMVaccine
SFB900: Microbial Persistence and its Control
RESIST: Resolving Infection Susceptibility
Mechanismen des HCV-Gewebe- und Speziestropismus
Repressors of viral infection, WO2017/207725A1
Reinecke, B., Frericks, N., Lauber, C., Dinkelborg, K., Matthaei, A., Vondran, F., Behrendt, P., Haid, S., Brown, R., & Pietschmann, T. (2022). The Human Liver-Expressed Lectin CD302 Restricts Hepatitis C Virus Infection. Journal of virology, 96(7), e0199521.
Brown RJP, Tegtmeyer B, Sheldon J, Khera T, Anggakusuma, Todt D, Vieyres G, Weller R, Joecks S, Zhang Y, Sake S, Bankwitz D, Welsch K, Ginkel C, Engelmann M, Gerold G, Steinmann E, Yuan Q, Ott M, Vondran FWR, Krey T, Ströh LJ, Miskey C, Ivics Z, Herder V, Baumgärtner W, Lauber C, Seifert M, Tarr AW, McClure CP, Randall G, Baktash Y, Ploss A, Thi VLD, Michailidis E, Saeed M, Verhoye L, Meuleman P, Goedecke N, Wirth D, Rice CM, Pietschmann T. Liver-expressed Cd302 and Cr1l limit hepatitis C virus cross-species transmission to mice. Sci Adv. (2020) Nov 4;6(45):eabd3233
von Schaewen M, Dorner M, Hueging K, Foquet L, Gerges S, Hrebikova G, Heller B, Bitzegeio J, Doerrbecker J, Horwitz JA, Gerold G, Suerbaum S, Rice CM, Meuleman P, Pietschmann T, Ploss A (2016) Expanding the Host Range of Hepatitis C Virus through Viral Adaptation. MBio 7(6)
Anggakusuma, Brown RJ, Banda DH, Todt D, Vieyres G, Steinmann E, Pietschmann T (2016) Hepacivirus NS3/4A Proteases Interfere with MAVS Signaling in both Their Cognate Animal Hosts and Humans: Implications for Zoonotic Transmission. J Virol 90(23): 10670-10681.
Frentzen A, Anggakusuma, Gurlevik E, Hueging K, Knocke S, Ginkel C, Brown RJ, Heim M, Dill MT, Kroger A, Kalinke U, Kaderali L, Kuehnel F, Pietschmann T (2014) Cell entry, efficient RNA replication, and production of infectious hepatitis C virus progeny in mouse liver-derived cells. Hepatology 59(1): 78-88.
Finanzierung:
NIH:HCV
RESIST: Resolving Infection Susceptibility
DZIF: DELPHI TTU 05.910
Antivirale Wirkstoffe gegen HCV, RSV und Coronavirus
Labyrinthopeptins as anti-viral agents EPA16809653.5, pending
Diagnostics and therapy for human respiratory syncytial virus (hRSV) EP17195522.2, pending
Risso-Ballester, J., Galloux, M., Cao, J., Le Goffic, R., Hontonnou, F., Jobart-Malfait, A., Desquesnes, A., Sake, S. M., Haid, S., Du, M., Zhang, X., Zhang, H., Wang, Z., Rincheval, V., Zhang, Y., Pietschmann, T., Eléouët, J. F., Rameix-Welti, M. A., & Altmeyer, R. (2021). A condensate-hardening drug blocks RSV replication in vivo. Nature, 595(7868), 596–599. https://doi.org/10.1038/s41586-021-03703-z
Blockus S, Sake SM, Wetzke M, Grethe C, Graalmann T, Pils M, Le Goffic R, Galloux M, Prochnow H, Rox K, Huttel S, Rupcic Z, Wiegmann B, Dijkman R, Rameix-Welti MA, Eleouet JF, Duprex WP, Thiel V, Hansen G, Bronstrup M, Haid S, Pietschmann T (2020) Labyrinthopeptins as virolytic inhibitors of respiratory syncytial virus cell entry. Antiviral Res 177: 104774.
Behrendt P, Perin P, Menzel N, Banda D, Pfaender S, Alves MP, Thiel V, Meulemann P, Colpitts CC, Schang LM, Vondran FWR, Anggakusuma, Manns MP, Steinmann E, Pietschmann T (2017) Pentagalloylglucose, a highly bioavailable polyphenolic compound present in Cortex moutan, efficiently blocks hepatitis C virus entry. Antiviral Res 147: 19-28
Pietschmann T (2017) Clinically Approved Ion Channel Inhibitors Close Gates for Hepatitis C Virus and Open Doors for Drug Repurposing in Infectious Viral Diseases. J Virol 91(2)
Perin PM, Haid S, Brown RJ, Doerrbecker J, Schulze K, Zeilinger C, von Schaewen M, Heller B, Vercauteren K, Luxenburger E, Baktash YM, Vondran FW, Speerstra S, Awadh A, Mukhtarov F, Schang LM, Kirschning A, Muller R, Guzman CA,
Kaderali L, Randall G, Meuleman P, Ploss A, Pietschmann T (2016) Flunarizine prevents hepatitis C virus membrane fusion in a genotype-dependent manner by targeting the potential fusion peptide within E1. Hepatology 63(1): 49-62.
Haid S, Grethe C, Bankwitz D, Grunwald T, Pietschmann T (2015) Identification of a Human Respiratory Syncytial Virus Cell Entry Inhibitor by Using a Novel Lentiviral Pseudotype System. J Virol 90(6): 3065-3073.
Koutsoudakis G, Romero-Brey I, Berger C, Perez-Vilaro G, Monteiro Perin P, Vondran FW, Kalesse M, Harmrolfs K, Muller R, Martinez JP, Pietschmann T, Bartenschlager R, Bronstrup M, Meyerhans A, Diez J (2015) Soraphen A: A broad-spectrum antiviral natural product with potent anti-hepatitis C virus activity. J Hepatol 63(4): 813-821.
Finanzierung:
BMBF: Validierung gezielter Lipid-Adressierung als neue Strategie für antivirale Substanzen mit breitem Wirkspektrum (LABoVIR) – Antivirale und toxikologische Tests
HZI: Pre-4D drug discovery
DZIF, MWK: Rapid identification of repurposing candidates & Discovery and development of broad-spectrum coronavirus antivirals
COFONI: COFONI "Antivirale Strategien: Wirk- und Impfstoffe"
HZI Creativity and Cooperativity Call: Targeting exoribonuclease activity of SARS CoV-2
Wirts- und Virusfaktoren, die die Empfänglichkeit für HCV und RSV kontrollieren
Diagnostics and therapy for human respiratory syncytial virus (hRSV) EP17195522.2, pending
Carpentier A, Sheldon J, Vondran FWR, Brown RJ, Pietschmann T (2020) Efficient acute and chronic infection of stem cell-derived hepatocytes by hepatitis C virus. Gut 69(9): 1659-1666.
Baier C, Haid S, Beilken A, Behnert A, Wetzke M, Brown RJP, Schmitt C, Ebadi E, Hansen G, Schulz TF, Pietschmann T, Bange FC (2018) Molecular characteristics and successful management of a respiratory syncytial virus outbreak among pediatric patients with hemato-oncological disease. Antimicrob Resist Infect Control 7: 21.
Weller R, Hueging K, Brown RJP, Todt D, Joecks S, Vondran FWR, Pietschmann T (2017) Hepatitis C virus strain-dependent usage of apolipoprotein E modulates assembly efficiency and specific infectivity of secreted virions. J Virol. pii: JVI.00422-17.
Vieyres G, Welsch K, Gerold G, Gentzsch J, Kahl S, Vondran FW, Kaderali L, Pietschmann T (2016) ABHD5/CGI-58, the Chanarin-Dorfman Syndrome Protein, Mobilises Lipid Stores for Hepatitis C Virus Production. PLoS Pathog 12(4): e1005568.
Haid S, Grethe C, Dill MT, Heim M, Kaderali L, Pietschmann T (2014) Isolate-dependent use of claudins for cell entry by hepatitis C virus. Hepatology 59(1): 24-34.
Finanzierung:
VolkswagenStiftung/MWK: INtegrative Data analytIcs for Respiratory syncytiAl virus RIsk Assessment
HZI: Pre-4D Diagnose RSV
RESIST: Resolving Infection Susceptibility